1714108614
2024-04-25 15:00:21
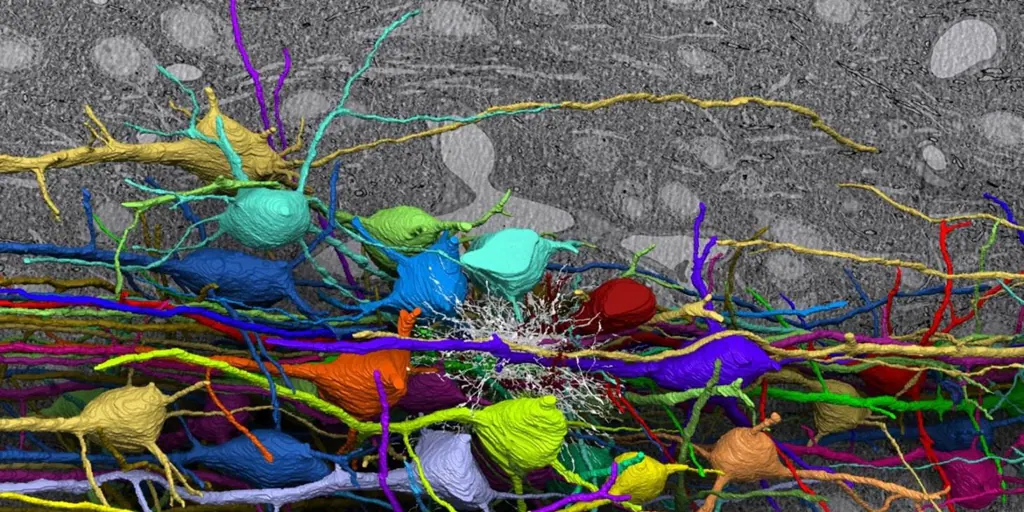
ネズミが、ネズミとして世界を体験するのはどんな感じなのかと考えたことがあるとしたら、今ではその夢を実現できる人もいます。 2つの独立した研究チームは、別の動物であるラットの幹細胞から成長させたニューロンを使用して、マウスの脳回路を再生することに成功した。 両方の研究は雑誌に掲載されました。細胞キメラが生成された’異なる種の2つ以上の異なるゲノムの組み合わせによって形成される生物– は、脳組織がどのように形成されるかについての貴重な情報を提供し、パーキンソン病などの病気や老化によって失われた脳機能を回復する新たな機会を提供します。
これは、動物が他の動物の感覚装置を使用して世界を正確に感知し、反応することができたのは初めてであり、脳が外部の脳細胞を統合する際にどれほど柔軟であるかを示しています。 「この研究は、合成神経回路を使用して脳の機能を回復することにより、脳の潜在的な柔軟性を示すのに役立ちます」と、同大学のクリスティン・ボールドウィン教授は述べています。 ニューヨークのコロンビア大学 (米国) であり、2 つの記事のうち 1 つの著者です。
ボールドウィンのチームは、 マウスの嗅覚神経回路ラットの幹細胞を使用して、嗅覚を担う脳内の相互接続されたニューロンとその機能を解明します。
人間の脳疾患を理解して治療する上での最大の課題の 1 つは、現在の研究方法ではこれらの疾患を完全に理解することが不可能であることです。
「ある種の脳組織を別の種の中で生成できることは、異なる種の脳の発達と進化を理解するのに役立ちます」と、同大学准教授のジュン・ウー氏は言う。 テキサス大学ダラス校サウスウェスタン医療センター そして他の記事の著者。
ハイブリッド脳により、研究者は脳細胞がどのように病気になったり死んだりするのか、また脳の一部の修復と交換のルールをより深く理解できるようになります。
Wu 氏のチームは、以下に基づいてプラットフォームを開発しました。 クリスパー これにより、特定の組織の発生を促進する特定の遺伝子を効率的に特定できる可能性があります。 彼らは、マウスの前脳の発達に必要な遺伝子をサイレンシングし、ラットの幹細胞を使用して組織を修復することによってプラットフォームをテストしました。
に説明する サイエンスメディアセンター リュディガー ベーア、デル ライプニツ霊長類研究所 (ドイツ) は、キメラは「2 つの異なる受精プロセス (胚) から生じる細胞で構成される生物である。種内キメラと種間キメラを区別する必要がある。種内細胞では、キメラ細胞は両方とも同じ種に属する。キメラはこれらの新しい研究でも生み出されました 種間 マウスとラットの間。 この場合、生物を構成する細胞は 2 つの異なる種に由来します。 種間キメラは、発生生物学および進化生物学の観点から特に興味深いものです。 しかし、種間生物は、ヒトの医療用の移植可能な臓器の生産に関して非常に貴重な洞察を提供することもあります。 「患者への移植のためのドナー臓器が数十年にわたって不足していることを考慮すると、これは優先的な研究目標です。」
キメラとハイブリッド
ベーア氏は、キメラは明確に区別されなければならないと付け加えた。 ハイブリッド。 キメラとは異なり、「ハイブリッドは単一の受精卵細胞から発生します。ただし、ハイブリッドでは、雄の精子と雌の卵子は2つの異なる(しかし密接に関連した)種に由来します。たとえば、ロバの精子はウマの卵子とうまく受精できます。」 得られた胚はラバに成長します。 雑種では、生物自体のすべての個々の細胞がすでに 2 つの親種の「混合物」になっています。 「一方、種間キメラでは、個々の細胞が明確に種に割り当てられます。」
マウスとラットは、約 2,000 万年から 3,000 万年にわたって独立して進化してきた 2 つの異なる種です。
以前の実験では、科学者は次のことを行うことができました。 ラット幹細胞を使ってマウスの膵臓を置き換える 胚盤胞補完と呼ばれるプロセスを通じて。
このプロセスを機能させるために、研究者らは、遺伝子変異により膵臓を発達させる能力を欠いているマウス胚盤胞(初期段階の胚)にラット幹細胞を注入します。 その後、ラットの幹細胞が失われた膵臓に発達し、その機能を補完しました。
現在まで、異なる種の幹細胞を使用した脳組織の生成は報告されていません。
しかし、これまでのところ、胚盤胞相補によって異なる種の幹細胞を使用して脳組織を生成することは報告されていません。
今回、ウー氏のチームは CRISPR を使用して 7 つの異なる遺伝子をテストし、 Hesx1 前脳を持たないマウスを確実に生成することができた。 次に、研究チームはラット幹細胞をマウス胚盤胞に注入した。 ノックアウト Hesx1の遺伝子が不活化または欠失している動物、そしてラットの細胞がニッチを埋めてマウスの前脳を形成した。
ラットはマウスよりも大きな脳を持っていますが、ラット起源の前脳はマウスと同じ速度と大きさで発達しました。 さらに、ラットのニューロンは隣接するマウスのニューロンに信号を伝達することができ、またその逆も可能でした。
さて、研究者らはラット幹細胞の前脳がマウスの行動を変えるかどうかはテストしなかった。 «ラットとマウスを区別するための行動検査が不足している -呉は認めます-。 「しかし、私たちの実験によると、この前脳ネズミは異常な行動をするわけではないようです。」
サイレント遺伝子
他の研究では、ボールドウィンのチームは、特定の遺伝子を使用して、嗅覚に使用されるマウスの嗅覚ニューロンを殺すか沈黙させ、ラットの幹細胞をマウスの胚に注入した。
サイレンシング モデルは、神経発達障害で見られるものを模倣しています。 特定のニューロンが脳とうまく通信できない場所一方、破壊モデルではニューロンが完全に除去され、変性疾患がシミュレートされました。
彼らは、胚盤胞の補完によりマウスの嗅覚神経回路がモデルに応じて異なる方法で回復することを発見した。 したがって、マウスのニューロンが存在するが沈黙している場合、ラットのニューロンは、ニューロンが除去されたモデルと比較して、より組織化された脳領域の形成に役立ちました。 しかし、研究チームがこれらのラットとマウスのキメラを、ケージに埋められた隠しクッキーを見つけるように訓練してテストしたところ、ラットのニューロンは2番目のモデルの方が救助行動が優れていたことが分かりました。
サイレンシングモデルは神経発達障害で見られるものを模倣しています
« この結果は本当に すばらしい 「これにより、これら 2 つの疾患モデルの違いを観察し、あらゆるタイプの脳疾患の機能回復に役立つメカニズムを特定することができます」とボールドウィン氏は言います。
彼のチームはまた、正常な嗅覚系を持つマウスの細胞を使用して、疾患モデルマウスにおける胚盤胞の相補性をテストした。 彼らは、種内の相補性が両方のモデルでクッキーの発見を救ったことを示しました。
パーキンソン病とてんかんに対する幹細胞由来のニューロンは現在、臨床試験で人体に移植されています。 ボールドウィン氏は、「この研究は、臨床試験よりもはるかに大規模な同種の脳補完の可能性を評価できるシステムを提供する」と強調する。
現在、胚盤胞の補完はヒトへの臨床応用にはほど遠いが、両方の研究は、異なる種の幹細胞がその発達を宿主の脳と同期させることができることを示唆している。
科学者たちはまた、胚盤胞補完を利用して、ブタなど他の種で人間の臓器を成長させる実験も行っている。 昨年、科学者らはブタのヒト幹細胞を使って腎臓を作製し、移植待機リストにある多くの人々に潜在的な解決策を提供した。
« 私たちの目標は、臓器移植者の転帰を改善することを目的として、一定割合のヒト細胞をブタの臓器に濃縮することです。 しかし、現時点では、臨床試験でこれをテストする前に、克服する必要のある技術的および倫理的な課題がまだたくさんあります」とウー氏は言います。
ハイブリッド脳に挿入される細胞の発達を制限できれば、霊長類のニューロンを使ったハイブリッド脳の作製への扉も開かれる可能性がある。 「これは人間の病気の理解にさらに近づくのに役立つでしょう」とボールドウィン氏は言う。
キメラ研究は、細胞や組織の置換療法をより迅速に患者が利用できるようにするための知識を生み出すのに役立つと信じているベーア氏にとって、それはそれほど明確ではないが、「ここで提示されたアプローチは、治療法として人間に直接応用できるアプローチではない」 「ここで紹介された研究は、脳の胚発生、その進化的適応、および脳の機能をより深く理解する上で非常に価値があります。」
生命倫理のジレンマ
そして見た目も忘れずに 生命倫理 「遅くとも、キメラ研究においてヒトの胚がレシピエントとして使用される場合には必要である。 個人的には、たとえドイツで許可されていたとしても、種間キメラ研究におけるヒト胚の使用は厳しく拒否します。 しかし、たとえヒトの幹細胞が動物の胚に移植されたとしても、それは生物医学の観点からは理にかなっているかもしれないが、生物医学と生命倫理の議論が行われるべきである。
ステファン・シュラット監督 ミュンスター大学病院生殖医療および男性学センター (ドイツ)。 「胚盤胞の補完は基礎研究にとって非常に興味深い分野を切り開きますが、臨床応用のための代替臓器の生成は現実的なシナリオではありません。 リスクを評価するには、種および臓器固有の影響に関する知識がまだ少なすぎるようです。 「クローン作成と同様、ここでも国際的に認められた一時停止措置が設けられるべきだ。」
結論として、ベーア氏は次のように述べています。 現代のキメラ研究はまだ初期段階にある。 「今回発表された 2 つの研究は、新しい治療アプローチへのトランスレーショナル アプローチをまだ提供していません。 「しかし、それらは新しい長期治療法を構築するための科学的知識に大きく貢献します。」
#神経疾患治療の第一歩