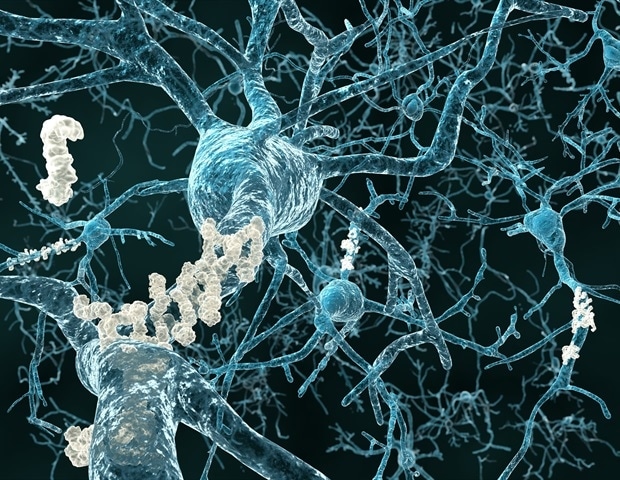
米国疾病予防管理センターによると、現在少なくとも 580 万人のアメリカ人が、最も一般的な認知症であるアルツハイマー病を患っている。アルツハイマー病には治療法がない。その理由の 1 つは、科学者がまだこの病気の原因を完全に理解していないためだ。しかし、スクリプス研究所の新しい研究は、アルツハイマー病の進行に寄与する可能性のある分子要因に光を当てている。
2011年に発表された研究では、 先端科学 2024年5月21日、研究者らはアルツハイマー病に罹患した単一の生きた脳細胞を研究するための新しい技術を使用しました。単一ニューロンの電気的活動とそれらのニューロン内のタンパク質レベルを測定することにより、科学者らはアルツハイマー病に関連する新しい分子を発見しました。将来的には、これらの分子が神経変性疾患を治療したり進行を遅らせたりする薬の標的となることが期待されています。
臨床神経科医のスチュアート・リプトン医学博士、タンパク質専門家のジョン・イェーツ3世博士、バイオインフォマティクス学者のニコラス・ショーク博士(トランスレーショナル・ゲノミクス研究所(TGen)の副所長兼定量医学の著名な教授でもある)を含むスクリプス研究所の教授陣の緊密な協力により、科学者たちはこのバイオテクノロジーの偉業を開発することができました。
「1 つの細胞を取り出し、その電気活動を 100 万分の 1 アンペアのオーダーで測定し、同じ細胞内の何千ものタンパク質を調べて、アルツハイマー病に関連した異常な電気活動を引き起こすタンパク質です」と、ステップ・ファミリー財団寄附教授であり、スクリップス・リサーチの神経変性新薬センターの共同所長でもある主著者のリプトン氏は言う。 「しかし、この方法の利点は、アルツハイマー病と関連する認知症の新たな標的を発見できることです。」
リプトン氏らによるこれまでの研究では、アルツハイマー病患者の脳では特定のニューロンが過剰に活動し、通常よりも強い、またはより頻繁に電気信号を送ることが示されています。証拠は、この過剰活動(過興奮としても知られています)がアルツハイマー病に関連する認知機能低下の一因となっていることを示唆しています。
新しい研究で、リプトン氏と同僚は、科学者が個々の脳細胞を正確に測定し、アルツハイマー病の影響を受けた細胞と健康な細胞を比較できるシステムを開発した。ニューロンの電気的活動を正確に測定する方法を以前に開発したリプトンのグループは、イェーツ氏と協力し、質量分析法を使用して各神経細胞内の2,250を超えるタンパク質のレベルを特定した。質量分析法は細胞からタンパク質を識別して定量化できるが、これらの分析は従来、大量の細胞集合体に対して行われてきた。最近の進歩により、単一細胞レベルでの測定が可能になっている。
シングルセル(sc)パッチクランプ/プロテオミクスと呼ばれる新しいシステムでは、塩溶液で満たされた小さなガラス管を電極として使用して細胞の電気的活動を測定し、その後、質量分析法によるタンパク質研究のために細胞を抽出します。
このアプローチにより、電気的機能の変動をニューロン内の分子イベントに結び付けることができるようになり、これはプロテオミクスの興味深い応用です。」
ジョン・イェーツ3世博士、タンパク質専門家
科学者らは、約150個のニューロンの電気パターンとタンパク質レベルを分析し、ショーク社が適用した計算ツールを使用して、過剰興奮性と異常なタンパク質レベルとの関連性を見つけた。 彼らは、健康な細胞と比較して過剰興奮性のアルツハイマー病細胞に高いまたは低いレベルで存在する約50のタンパク質を特定した。
「これらのタンパク質の一部はアルツハイマー病と関連していることがすでに知られていましたが、多くはそうではありませんでした」とリプトン氏は言う。
これらのタンパク質は、フリーラジカルの電子制御(酸化還元調節因子)、エネルギー代謝、炎症など、ニューロンのさまざまな機能に関与していました。 タンパク質のうち 15 個は、アルツハイマー病のニューロン内で特に高いまたは低いレベルを示すことが際立っており、リプトンのグループはこれらの分子のいくつかについて追跡調査を計画している。
彼はまた、潜在的なアルツハイマー病治療薬がニューロンの過剰興奮性と異常なタンパク質レベルの両方を修正するかどうかをテストする薬剤スクリーニングへの scPatch-Clamp/プロテオミクスの使用を拡大することも計画しています。 彼はこれらの発見を、大脳オルガノイド、または「ミニ脳」として知られるアルツハイマー病患者から得られたより大きな脳細胞のグループでの実験と関連付けている。
「一つの細胞が常にすべてを語るわけではない」とリプトン氏は説明する。「アルツハイマー病の機能障害の一部は、細胞同士の相互作用に関係しているため、ミニ脳オルガノイドでこの種の研究を繰り返すことができれば、さらなる発見ができるかもしれない」
リプトン氏は、この方法が他の脳関連疾患の創薬活動にも応用できる可能性があると指摘している。
「アルツハイマー病のニューロン1個のタンパク質発現と電気的活動に基づくこの新しい個別化医療のアプローチは、この病気だけでなく、他の治療領域に大きく遅れをとっている他の神経疾患に対する新薬発見に革命をもたらす可能性がある」と同氏は付け加えた。
リプトン氏とイェイツ氏に加え、「ヒトアルツハイマー病iPSC由来興奮性ニューロンと同質野生型対照の単一細胞パッチクランプ/プロテオミクスは、新たな原因と治療ターゲットを示唆する」という研究の著者は、スクリプス研究所のスワガタ・ガタック氏、ジョリーン・K・ディードリッヒ氏、マリア・タラントヴァ氏、ヘンリー・スコット氏、ミータル・シャルマ氏、マシュー・アルバートレ氏、およびトランスレーショナル・ゲノミクス研究所のニヴェディタ・バドラ氏とニコラス・J・ショルク氏(ショルク教授はスクリプス研究所の共同研究者)である。
この研究は、国立衛生研究所 (R01 AG056259、R35 AG071734、RF1 AG057409、R56 AG065372、R01 DA048882、DP1 DA041722、F32 ES031815、R01MH100175、R21 MH1296776、UH3) からの資金提供によって支援されました。 AG064706、U19 AG023122、U19 AG065169、および U24 AG078753)。
ソース:
ジャーナル参照:
ガタク、S. (2024)。 ヒトアルツハイマー病 iPSC 由来興奮性ニューロンと同質遺伝子野生型対照の単細胞パッチクランプ/プロテオミクスは、新たな原因と治療標的を示唆する。 先端科学。 doi.org/10.1002/advs.202400545。
1716495147
#画期的な研究でアルツハイマー病進行の分子要因が明らかに
2024-05-23 19:57:00
:strip_icc():format(jpeg)/kly-media-production/medias/4819817/original/092486800_1714652852-Note_40_Pro_5G_3.jpg)





:quality(70):focal(1483x1007:1493x1017)/cloudfront-eu-central-1.images.arcpublishing.com/irishtimes/WOSUFZ7C2FDLVEFKCML2OOS2EE.jpg)


